

光纤光度法越来越多地用于监测大脑神经活动的荧光传感器。然而,大多数简单的实现都是基于扁平切割光纤,这种光纤只能与靠近光纤的浅层组织体积相连接。我们利用锥形光纤的模态特性,使光收集超过2毫米的组织和沿锥度的多点光度测定。使用单个锥形光纤,我们同时观察到自由运动小鼠执行简单的操作性条件反射任务时背侧纹状体和腹侧纹状体中不同的多巴胺瞬变。通过微结构锥形的非平面表面,锥形光纤的收集体积也可以在形状和大小上进行工程设计,不仅可以在脑深部,而且一般来说,在任何生物系统或器官中,光收集是有益的,但由于光散射和吸收而具有挑战性。
展示全部 
用单个锥形光纤植入物进行深度分辨光纤光度测定
(转译自文献Depth-resolved fiber photometry with a single tapered optical fiber implant)
活体荧光检测可用于记录和研究自由运动动物脑深部遗传定义的神经群的功能信号。例如,纤维光度法通过监测特定细胞类型神经活动时荧光随时间变化来实现。这些方法推动了基于光子学和光电子平台技术以及使用多路复用技术记录多个亚种群活动方法的发展。通常情况下,光纤测量方案依赖于扁平切割光纤进行刺激和收集荧光2-9,11 - 19。
然而,由于组织散射和吸收效应,扁平切割光纤的可访问记录深度仅限于光纤尖端附近,这与探针的几何形状相结合,决定了荧光激发和收集效率20,21。简单的几何计算表明,扁平切割光纤收集的信号量随着与光纤面距离的增加而急剧减少。此外,重新配置收集几何形状以达到多个区域是不可能的,因为改变光收集场需要重新定位光纤。此外,扁平切割光纤的几何形状严重损害组织,在大脑中,甚至在植入后很长一段时间内,也会诱导装置周围的神经胶质激活22,23。尽管如此,平劈光纤被广泛用于评估脑深部区的神经活动3,11-19。
在这里,我们提出了一种克服这些限制的方法:我们利用TF中光传播的模态特性在锥度的大光学活性区域上构造光收集模式并进入更深的细胞。除了比扁平切割光纤22具有更小的侵入性外,TF探针还具有独特的光收集特征,包括:(i)沿光纤轴在高达2mm的组织上具有均匀的界面,(ii)通过分时多路复用沿锥度进行多点收集的能力,以及(iii)通过微结构光纤锥度的非平面表面来设计任意收集体积的能力。
下面,我们量化了锥形光纤的三维(3D)光采集区域,发现锥形光纤在大区域(如小鼠的大脑皮质和纹状体)均匀地收集荧光。当与大面积光传输相结合时22,24,这导致在有源光学表面相似的照明功率密度下,锥形光纤比扁平切割光纤的信号采集更高。这是因为大面积的锥形光纤可以提供更多的总照明功率,即更多的光子,同时将电池暴露在中等的功率密度下。我们的研究表明,通过利用选择性光传递和收集,转录因子能够在自由运动的动物中对功能性荧光信号进行多点探测,包括沿着纤维锥度动态记录来自多个脑区的信号。我们通过在自由运动的小鼠中使用单个锥形光纤完成奖励收集任务,快速扫描兴奋光并同时监测背侧和腹侧纹状体的多巴胺瞬变,证明了这种实验的可行性。
zui后,我们将控制光沿锥度传播的模态效应与金属涂层锥形光纤表面的微观和纳米结构相结合,从而设计了收集体积25,26。我们将收集体积限制在锥度表面的一个角部分,这样,光学窗口位于沿着锥形光纤界面的特定深度,只有很少的细胞体。这种方法与光学窗口的选择性光传输相结合,提供了具有高度空间选择性的深度细胞体积的双向接口。
结果
锥形光纤的光收集特性
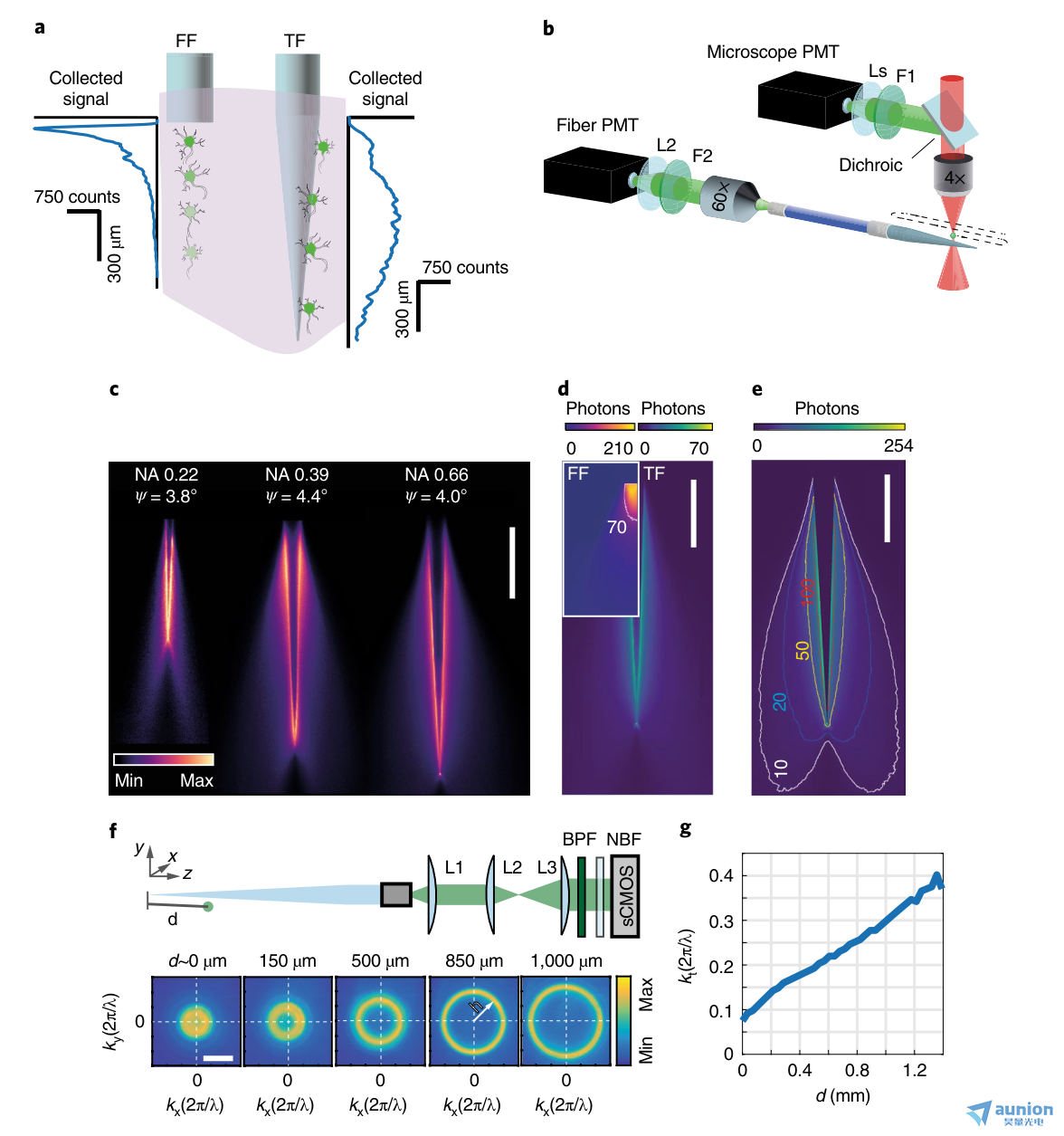
图1 |锥形光纤的光收集。a,脑组织中扁平切割光纤(FF)和锥形光纤(TF)的光采集示意图。实验收集概况旁边的纤维。b,对锥形光纤的光采集场成像的光学设置。在pbs -荧光素滴中,一个围绕锥形光纤的双光子激发点被扫描。产生的荧光可通过未脱膜的PMT(显微镜PMT)和补片光纤远端的光纤PMT检测。Ls,透镜系统;F1和F2,带通荧光滤波器;L2,镜头。c,在PBS-荧光素溶液中,随着NAs的增加锥形光纤的典型ξT(x,y)集合字段(每个字段归一化到其zui大值);比例尺,500µm。d,比较在pbs -荧光素溶液中扫描的双光子荧光光斑采集的光子数(像素停留时间,3.2µs),内嵌扁平切割光纤与NA = 0.66, ψ = ~4°的锥形光纤;FF图中的等值线显示锥形光纤收集到的zui大光子数。比例尺,500µm。e, NA-0.66 锥形光纤在pbs -荧光素溶液中的光子收集的等距线(顶部色条,每个像素的光子数;停留时间,3.2µs);等值线在10、20、50和100光子处绘制。比例尺,500µm。f,上,远场成像系统示意图。L1、L2、L3,成像镜;BPF,带通滤波器;NBF,近红外阻断滤波器;sCOMS,科学互补金属氧化物半导体。底部,纤维输出小关节的远场图像显示,当光源沿着锥形光纤移动时,直径增加的环。比例尺,0.3 2π/λ。g, 锥形光纤在距离锥尖d处采集的点状光源荧光的横向矢量分量kt。a-d的实验重复了至少10次,得到了相似的结果。
我们在准透明的荧光溶液中表征了锥形光纤的光聚集特性(图1)。我们在浸泡锥形的pbs荧光素(30µM)液滴中实现了一个双光子扫描系统,以产生局限的荧光斑,就像各向同性的点状源一样(图1b)。光栅扫描锥度周围光斑时产生的荧光由与扫描头同步的两个光电倍增管(PMT)收集:(i)显微镜PMT,放置在标准的非脱封,外荧光路径,和(ii)光纤PMT,置于连接的光纤贴片的远端至锥形光纤20、21(图1b)。用显微镜PMT得到的参考图像对视场中双光子激发效率的轻微不均匀性进行校正后,来自光纤PMT的信号报告了锥形光纤的荧光光采集场,定义为ξT(x,y)。测量了不同数值孔径(NAs)和芯径,但锥度角(ψ)近似为~4°的光纤的集合场ξT(x,y)(图1c)。我们发现沿锥度的光敏区域,即收集长度L,随着光纤NA的增大和ψ的减小而增大(补充图1a)。因此,锥形光纤的采集长度是可以定制的通过修改光纤NA和锥度角ψ,从几百微米提高到约2 mm。这一发现揭示了锥形光纤和扁平切割光纤的收集特性的重要差异,因为对于扁平切割,收集深度基本上不依赖于NA21。
我们比较了锥形光纤和扁平切割的采集字段,NA分别为0.66(图1d)和0.39(补充图1b)。锥形光纤的光学主动表面沿波导轴线延伸,导致沿锥度方向相对均匀的收集。从集合字段ξF(x,y)中可以看出,扁平切割光纤在端面附近采集到较高的信号强度。相反,锥形光纤的收集效率曲线在锥度面附近达到一个较低的zui大值,并遵循在尖端增宽的两叶形状(图1e和补充图1c、d和2)如图ξ(x,y,z)区域所示(补充图1d),被采集信号围绕锥度轴完全对称。
这是因为锥形光纤表面通过增加波导直径27的横向传播分量kt的模态子集与周围环境进行光学界面。因此,由光纤的直部分所支持的全部传播模式逐渐沿锥形填充,导致锥形光纤轴的均匀收集。相反,扁平切割光纤的所有传播模式都在纤维面耦合。
为了更好地表征锥度采集光的物理特性,我们从靠近锥度表面的点样点对荧光进行双光子激发时,对所采集光的远场进行成像(图1f)。我们发现不同的模态子集在特定的锥度直径下被填充(图1f,g),因为相机上的图像是一个环,它的半径随着荧光源和锥度尖端之间的距离的函数而增加。环半径h是直接测量与进入纤维的导模相关的波矢量的横向分量kt 27,28。因此,光线从锥体的不同截面进入,受到不同的引导模式子集的引导,在相机上产生不同直径的环,从而建立了h与荧光信号沿锥体的位置之间的相关性。
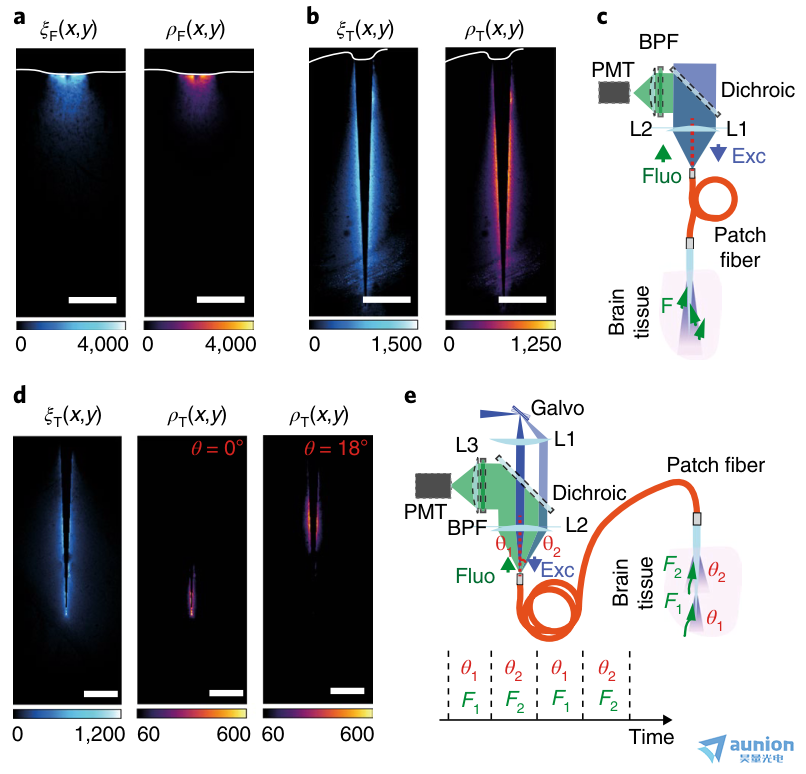
图2 |可重构的锥形光纤光收集。a,与荧光素均匀染色脑片皮质接触的0.66 NA 扁平切割光纤的光采集场ξ(x,y)(左)和光度效率场ρ(x,y)(右)。b,与a一样,将0.66-NA 锥形光纤插入经荧光素均匀染色的脑切片中。c,使用全NA照明和蓝色激光刺激并收集大大脑区域荧光的系统示意图。收集的光在贴片光纤中反向传播,并通过一个二色镜将其导向PMT与蓝光区分开来。L1和L2,晶状体;BPF,带通滤波器;Fluo,荧光信号;Exc,激发光。d,定点照明将采样体积限制在锥形光纤的子区域。左,集光域ξT(x,y);中心,在光纤尖端选择性照明得到的光度效率场ρT(x,y);右,ρT(x,y)视场是在较宽锥度直径下选择性照明获得的。e,提出的多站点光度测量系统的原理图,该系统使用时分复用配置的PMT探测器。蓝色激光束以增加的输入角(θ1, θ2)射入光纤贴片线。低角度注入时,激光在锥尖处耦合,产生荧光信号F1;相反,当在θ2处注入时,激光在较大锥度直径下耦合,产生荧光信号F2。荧光由PMT检测,其输出信号与光注入刺激同步。该荧光信号根据其时间戳归属于相应的区域。a、b、d实验重复三次,结果相似。
在大而深的区域统一收集
为了证明在存在散射和吸收的情况下,锥形光纤可以在大的和深部脑区获得均匀的采集,我们测量了均匀荧光染色的脑片上扁平切割光纤和锥形光纤的荧光采集场ξ(x,y)和荧光激发场β(x,y)。结合这些场得到了光度测量效率场ρ(x,y),它描述了荧光信号对激发光强度的依赖性20,21,从而给出了采样组织体积的详尽几何信息。我们比较了匹配NA和内核大小的扁平切割光纤和锥形光纤的采集和光度视野。如图2a所示,插入到皮层表面的扁平切割光纤域ξF(x,y)和域ρF(x,y),扁平切割光纤有效地与皮层的浅层连接;然而,他们只提取了距离透镜面300 μm以外的信息。相反,锥形光纤的界面更均匀,锥体的光学活性区域周围有脑组织(图2b)。利用ξ(x,y)的对称性,我们计算了由波导采样的体积作为采集信号的函数(补充图3),并确定了产生给定比例的总采集信号的组织体积。我们发现锥形光纤的体积比扁平切割光纤大(补充图4)。这一特性可以在使用全锥度表面来激发和收集信号的实验中加以利用(图2c)。
沿锥度可重新配置多站点收集
使用位点选择性光传输和模分解复用策略,锥形光纤的收集量可以沿着锥度在多个位置之间动态切换22,27,28。为了定义可寻址的体积几何配置,我们获得了一个插入到荧光素染色脑片上的0.66-NA 锥形光纤的ξT(x,y)集合域(图2d)。使用基于振镜的快速扫描系统(图2e),我们通过增加kt激发模态子集将激光注入锥形光纤,从而将照明体积限制在可通过改变光输入角度22、27、28沿锥度部分逐渐移动的有限区域(补充图5a、b)。由于荧光只在有限的被照射组织中产生(补充图5a、b),锥形光纤可以动态地检查一个功能区的多个位点。作为原理证明,我们结合ξT(x,y)和β(x,y),测量了由选址照明产生的光度测量效率场ρT(x,y)。ρT(x,y)在可从光线注入角度推断的有限区域内zui大(图2d)。利用这一特性,荧光信号可以归因于使用时分复用被照亮的大脑区域(图2e)。这是通过增加输入角(θ1, θ2)将激光发射到光纤补片线来激发沿锥度在限制位置耦合的不同模态子集来实现的。每个照明位置产生的荧光(分别为F1、F2)由锥度采集,在光纤补片线中反向传播,由二色镜识别,zui后由PMT检测,PMT输出信号与光注入刺激同步(图2e)。
为了证明这种方法对可能由动物运动引起的模态混合有弹性22,我们在pbs -荧光素浴中进行深度分辨光度测量时,在手动摇动光纤贴片的同时监测了远场模式。记录到的强度波动<1%,远场环直径和厚度变化<0.8%(对于未受扰动的纤维;补充图5c、d和补充视频1、2)。
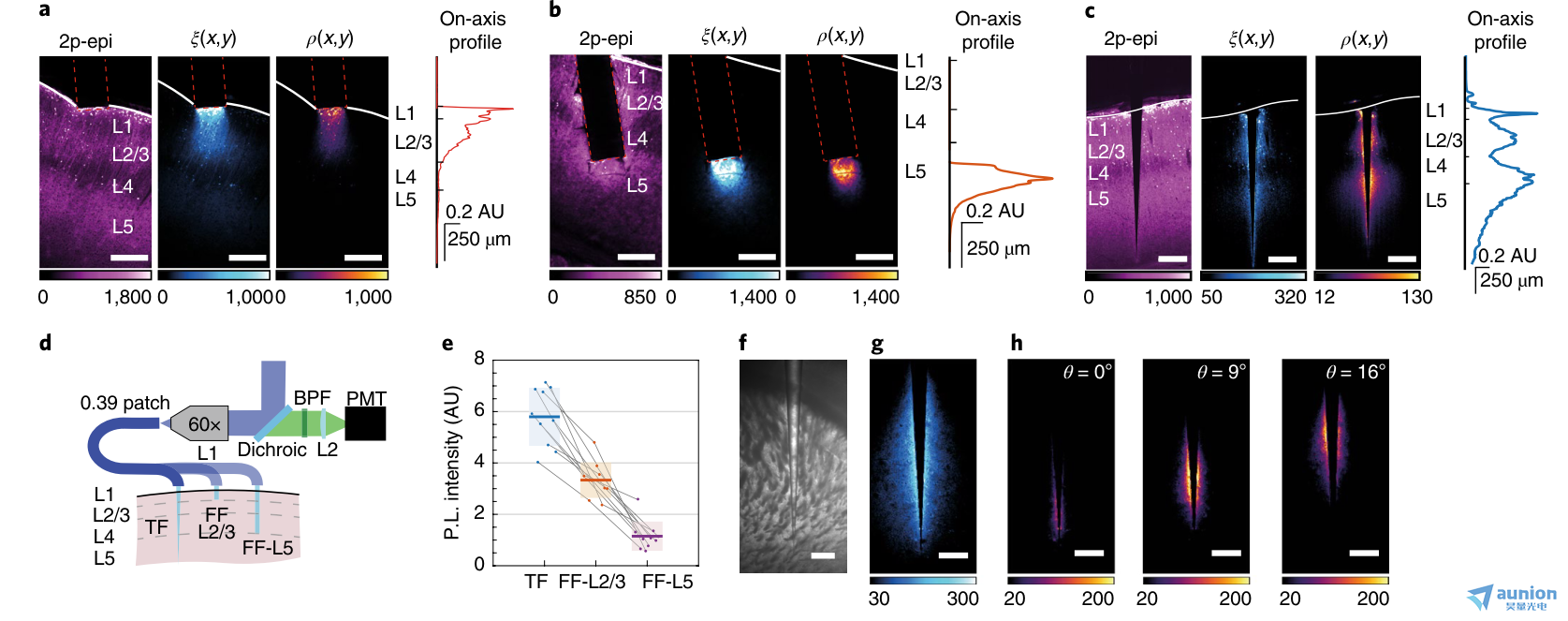
图3 |基因染色的神经群增强的光度测定。a,皮质表面0.39-NA 扁平切割光纤的光采集;从左到右:双光子表观荧光(2p-epi)图像,ξ(x,y)场,ρ(x,y)场,轴上采集轮廓ρ(x,y)。b, a为NA = 0.39 扁平切割光纤,接近L5。c, a,b表示一个在大脑皮层插入的0.39 NA的锥形光纤。比例尺(a−c), 250µm。d,三种实验配置的光度测量系统示意图:一个锥形光纤插入整个皮质,一个扁平切割光纤插入L2/3,一个扁平切割光纤插入至L5。e, Thy1-ChR2-EYFP小鼠脑片的荧光信号强度(n = 10),在大脑皮层插入0.39 NA 锥形光纤(ψ = 4°)(蓝色),在L2/3插入0.39- NA 扁平切割光纤(橙色),在L5插入0.39- NA 扁平切割光纤(紫色)来刺激和检测荧光。调整激光功率以获得相似的光活性区域的功率密度(0.1 mW mm-2)。阴影区域表示平均值上的标准误差。灰线连接在同一实验中从同一脑片获得的数据。采用双侧Student t检验进行统计学分析,显著性α = 0.001。f, 锥形光纤插入固定脑片纹状体的亮视野图像(Thy1-ChR2-EYFP小鼠)。g, f. h中锥形光纤的光采集域ξT(x,y),将ξT(x,y)域与位点选择性传递光相结合,产生可重构的纹状体子区域多位点光采集效率域ρT(x,y)。比例尺(f−h), 250µm。在a-c、g、h重复实验3次,结果相似。
增强荧光法在基因染色的神经群体
对于锥形光纤,我们使用了0.39-NA 锥形光纤 (ψ = ~4°)和扁平切割光纤来刺激和检测Thy1-ChR2-eYFP小鼠固定脑片不同皮质层的荧光,其中EYFP仅限于L2/3和L5(图3a-c)。我们测量了三种实验配置的ξ(x,y)、β(x,y)和ρ(x,y)场:靠近浅层的FF(图3a)、插入L5层的FF(图3b)和穿过皮质范围的锥形光纤 (图3c)。正如预期的那样,锥形光纤刺激并收集了L2/3和L5层的荧光,而扁平切割光纤在靠近关节突的一个有限区域内募集信号,需要重新定位以处理这两个区域。此外,光纤纤维钝的几何轮廓阻碍了光纤的插入,因为当光纤穿过切片时,移位的组织仍然在关节突的前面。
我们比较了三种实验配置产生的绝对信号水平(图3d),通过调制激光功率来补偿锥形光纤的较大光学活性区域,并在每个光学表面提供相同的平均功率密度(~0.1 mW mm-2)。在这些条件下,锥形光纤在两个深度都相对于扁平切割光纤产生了更大的荧光信号(图3e),这可以解释为在光收集和光传输中分模解复用的综合作用。在保持中等功率密度的情况下,模式分复用将较高的总照明功率分布在较宽的表面22,27。随着更多的光子被释放到组织中,更多的神经元参与到收集信号中,更多的荧光被产生和检测到,这与之前的研究结果一致,在较低的输出功率下锥形光纤比扁平切割光纤更能引起光遗传激活22。重要的是,由于光漂白依赖于每个荧光团的光暴露,当全部的光活性区域被吸收时,锥形光纤在更大体积的组织上的光分布允许产生更多的荧光而不增加光漂白。

图4 |体内多点光度法揭示了多巴胺对背侧纹状体和腹侧纹状体运动和奖励的不同反应。a,顶部,用于活体光纤光度测定的手术部位和两个部位锥形光纤照明示意图。下面是行为室的示意图。红色区域表示鼠标需要进入盒子的区域来触发容器(蓝色)中的食物颗粒的递送。在奖励交付后,至少需要30秒的时间才能交付另一个奖励。b,来自一只老鼠的光度信号示例。上面,行为时间戳是通过红外光束在容器中测出的。青色,奖赏的容器入口;洋红色,没有奖励的容器入口。中间,动物的中心速度。底部,dLight光度信号。红色,来自背部的信号;蓝色,腹侧信号。c,来自示例小鼠的所有试验的dLight光度信号的热图(两个阶段)。上方,来自背部的信号。底部,来自腹侧的信号。每一行代表一个单独的试验。N = 37次奖励容器进入试验。N = 435例无奖励进入容器的试验。N = 52次运动启动试验。d,小鼠所有会话的平均速度和dLight光度信号。来自背部的信号显示为红色;来自腹侧的信号显示为蓝色(n = 8次,来自4只小鼠)。阴影区域代表会话平均值的标准误差。
体内空间分辨光度法
为了更深入地了解构成运动行为和奖赏驱动行为基础的神经过程,光纤光度法已被用于探测纹状体神经元的活动11-13,29。在这种情况下,锥形光纤通过使用一个远程控制的植入物对多个区域进行采样来扩展实验能力。为了支持这一论点,我们用纹状体中的锥形光纤对位点选择性荧光法进行了表征(图3f)。我们将一个0.66-NA 锥形光纤插入Thy1-ChR2- EYFP小鼠固定脑片的纹状体中,在获得ξ(x,y)场(图3g)后,我们使用位点选择性照明来产生增加输入角度时的光度测量效率ρ(x,y)场(补充图5)。正如预期的那样,随着光输入角度的增加,响应位点选择性照明的体积逐渐远离锥形光纤尖端(图3h)。
我们使用dLight1.1(参考文献30)同时测量背侧纹状体和腹侧纹状体的多巴胺瞬变,在体内测试锥形光纤系统,这两个脑区显示出不同的多巴胺信号31。我们在一个简单的操作性条件反射范式中训练小鼠,在此期间我们从背侧和腹侧纹状体收集dLight荧光(图4a, NA = 0.39)。在这个实验中,老鼠必须待在房间的一边,才能触发食物奖励从位于房间另一边的容器中传递出来。这迫使老鼠从房间的一边跑到另一边去收集奖励,并在消耗容器中的奖励时停止移动。
我们在腹侧纹状体中观察到经典的奖赏驱动的多巴胺瞬变,其中dLight荧光在奖赏受体进入期间增加,在无奖赏进入期间减少(图4b-d;补充图6所示的所有试验均为单独的小鼠)。然而,对于奖赏和未奖赏的受体条目,背侧dLight荧光均下降,这表明背侧纹状体中的多巴胺释放与运动变化的相关性更强,而不是与奖赏的获得(图4b-d)。此外,在奖赏受体进入时,背侧纹状体和腹侧纹状体由行为引起的多巴胺变化的迹象相反,并且与多巴胺在运动启动中的功能一致32,33,两个部位的信号在运动启动期间增加(图4b-d)。因此,虽然背侧纹状体和腹侧纹状体多巴胺瞬变均追踪运动,但只有腹侧纹状体的多巴胺瞬变对奖励有强烈反应。
带有微结构锥形光纤的设计集光体积
锥形光纤与环境界面的大表面允许根据感兴趣的区域设计收集量(图5)。这可以通过使用微纳米制造技术来构建光纤的锥度来实现,正如在光传输中所显示的那样25,26,34。在这里,我们展示了:(i)光收集在波导周围特定角度范围内的限制(图5a-d), (ii)当光收集被限制在沿锥度的特定点时,在深层皮质层中对细胞体的观察(图5e-l), (iii)选择性照明和从两个光学窗口收集,通过操纵激发激光束分别解决(图5m,n)。
为了限制光的收集到波导表面的一半,我们对其对面的高反射铝层进行热蒸发(图5a)。半包被的TF在光学表面的ξ(x,y)(图5b)和剖面(图5c)与未包被的双探针在形状和收集到的光子数方面相似。因此,金属涂层并没有实质性地改变检测到的信号,这表明几乎所有进入未涂层锥度的光子都经历了介电全内反射,这是由半涂层光纤中的金属层强迫的。我们将半包被的锥形光纤插入由Thy1启动子控制的表达EYFP的固定脑切片中,在组织中测试了该装置的侧采集特性(图5c)。我们获得了一个双光子的表荧光图像和ξ(x,y)场,并发现尽管在光纤周围都产生了荧光,但光纤PMT只获得了在光纤的未涂覆部分附近产生的荧光(图5d)。
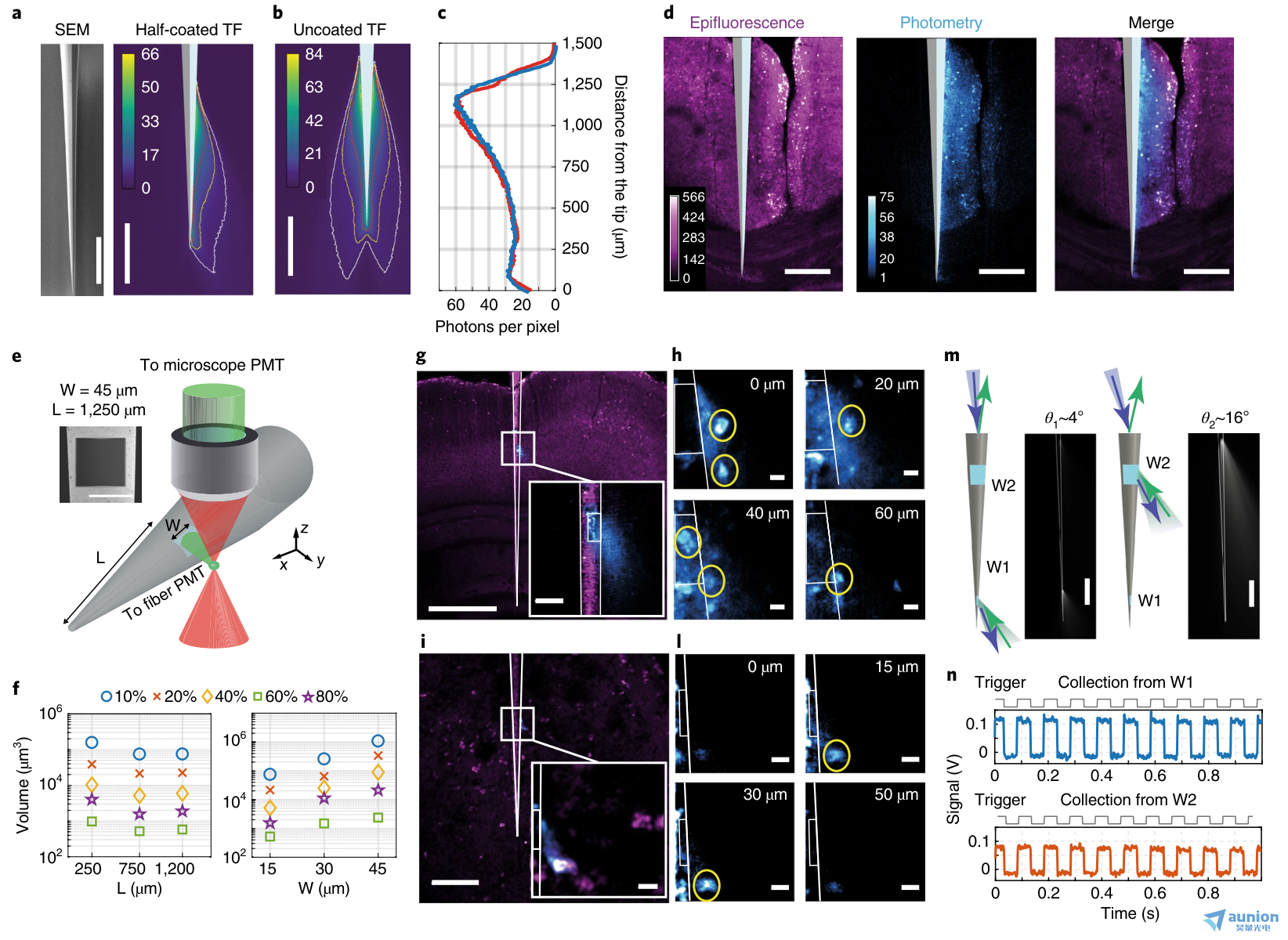
图5 |用微结构锥形光纤设计集光体积。a,左,半金属化TF的扫描电子显微图(SEM)。右,在pbs -荧光素溶液中,ξ(x,y)场对半涂覆的0.39-NA TF。b, ξ(x,y)场在pbs -荧光素溶液中。等值线分别用白色、黄色和红色表示每像素5、10和20个光子(停留时间3.2µs)。c, ξ(x,y)对于半涂覆锥形光纤(红色)和未涂覆锥形光纤(蓝色)的场分布。d,在固定的脑切片中收集半涂层TF (Thy1-ChR2-EYFP小鼠)。从左到右:双光子表荧光,ξ(x,y)场,合并表荧光(品红)和ξ(x,y)(青色)。比例尺(a-d), 250µm。e,设置用于表征从光学窗口的光收集。插图,正方形窗的SEM显微图(W = ~45µm, L = ~ 1250µm)。f,与L和W相比,由采集等值面包围的pbs -荧光素溶液的采集量分别为zui大采集量的10%、20%、40%、60%、80%(补充图6)。g,固定脑片(Thy1-ChR2-EYFP小鼠)的方形窗光采集(W = ~45µm, L = ~750µm);该图像显示了ξ(x,y)域(青色)与同时获得的双光子表观荧光图像(品红)的叠加;比例尺,500µm。插入,放大窗口;比例尺,50µm。h,在光学窗口上方随高度增加的Z-stack(0、20、40、60µm)。锥形光纤配置文件和窗口位置用白色表示。比例尺,10µm。i,与g一样,当TF的时间窗W = ~20µm时,L = ~230µm;比例尺,100µm(插图,10µm)。l,如h,对于W = ~20µm的光学窗口:高度为0、15、30、50µm的z-stack;比例尺,10µm。m,设置用于选择地点的照明和收集。锥形光纤被淹没在pbs -荧光素滴中。激光束脉冲(10 Hz, 50 ms, 473 nm)在受控θ下注入(补充图7c)。比例尺,500µm。n,从W1和W2窗口测量的荧光信号,通过操纵θ独立激活(荧光信号通过减去自身荧光校正)。c、d、g-l、n实验重复3次,结果相似。
从任意深度的光学窗口收集光
我们探索了在全铝涂层的TF上制造光学窗来进一步限制收集体积的可能性,我们使用聚焦离子束研磨来选择性地去除锥形特定区域的金属25,26。为了优化该装置,我们如上所述对PBS-荧光素溶液(30µM)中光学窗口的光收集进行了表征。我们制作了不同边长(W = 60、30、15µm)的光学窗平方的探针(NA = 0.39),放置在距离光纤尖端不同距离(L = 230、750、1,250µm)处(图5e、f)。这些设备的体积收集图(补充图7a)显示,较大的窗口导致较大的收集量(图5f)。然而,尽管靠近尖端的窗口从略大的体积中收集,但在较大的锥形截面上的窗口具有相似的收集特性(图5f)。
我们在Thy1-ChR2-EYFP小鼠的固定脑片上,通过采集ξ(x,y)场与同步外荧光成像相关联,测试了微结构锥形光纤的光学性能。我们发现,对于窗宽W = ~45µm,位于距锥尖L = ~750µm的锥形光纤,光集合与光学窗口位置共定位,其集合叶不垂直于纤维轴,而是指向锥尖(图5g)。这一特性与来自光学窗的选择性光传递密切相关25,因为它允许在深度上与细胞体积进行界面,具有高空间选择性(图5h)。此外,从光学窗口附近的区域获得的三维荧光堆栈(侧W = ~45µm, L = ~750µm)(图5h和补充图7b)显示了光度图和表观荧光成像的精确匹配。我们使用窗口宽度W = ~25µm的锥形光纤得到了类似的结果,锥形光纤位于距尖端L = ~230µm处(图5i, L)。
正如我们所展示的,对于未涂覆的锥形光纤,可以利用分模解复用策略选择性地激发和收集来自同一锥形光纤不同截面的两个光学窗口的荧光(图5m和补充图7c)。为此,我们将微结构锥形光纤浸入荧光素滴中,并在不同的输入角度注入473 nm的激光束,以每次选择一个窗口(补充图7c)。我们用声光调制器(10 Hz, 50%占空比方波)调制激光功率时,用光电探测器测量采集到的荧光信号(图5n)。荧光在每个窗口位置被选择性激发,表明锥形光纤可以选择性地照亮和收集来自两个受限区域的光(图5m,n和补充图7c)。
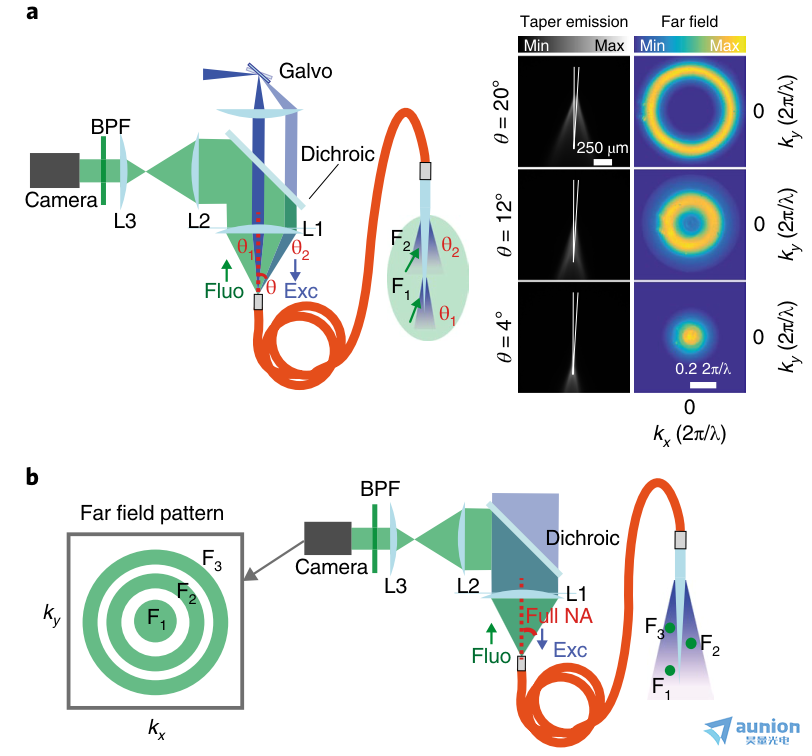
图6 |利用远场成像进行深度分辨光纤测光的检测方案。a、远场检测荧光支持时分复用,提高深度选择性。b,通过全NA刺激实现远场检测,实现基于反向传播荧光的kT值的纯分模解复用。Fluo,荧光信号;Exc,激发光。
讨论
在神经科学中,从大脑中表达的活动指示器获取荧光信号是一项强大的技术35,36,可植入式波导系统将极大地造福神经科学领域,该系统可配置为有效和选择性地收集感兴趣区域的光。此外,本文中提出的方法可以在使用远场检测来获得光纤光度实验中的深度选择性方面打开进一步的视角(图6)。
我们设想应用锥形光纤探针从散射组织中收集荧光,将有助于解剖脑深部多个功能区的贡献,同时为现有的光学方法提供一个通用的补充。基于锥形光纤的分模解复用的光度测定方法也可以潜在地扩展到大类别的软的、生物的、活组织,其中大脑代表了散射特性方面zui具挑战性的情况之一,考虑到散射长度和各向异性。在这个框架中,锥形光纤为现有的光收集设备增加了有益的功能,使用了扁平切割光纤或µLED/光电探测器系统无法实现的不同配置10。
上海昊量光电作为OptogeniX锥形光纤探针及扫描系统在中国大陆地区代理商,为您提供专业的选型以及技术服务。对于在有兴趣或者任何问题,都欢迎通过电话、电子邮件或者微信与我们联系。
如果您对OptogeniX锥形光纤探针及扫描系统有兴趣,请访问上海昊量光电的官方网页:
https://www.auniontech.com/details-2086.html
欢迎继续关注上海昊量光电的各大媒体平台,我们将不定期推出各种产品介绍与技术新闻。
更多详情请联系昊量光电/欢迎直接联系昊量光电
关于昊量光电:
上海昊量光电设备有限公司是光电产品专业代理商,产品包括各类激光器、光电调制器、光学测量设备、光学元件等,涉及应用涵盖了材料加工、光通讯、生物医疗、科学研究、国防、量子光学、生物显微、物联传感、激光制造等;可为客户提供完整的设备安装,培训,硬件开发,软件开发,系统集成等服务。
您可以通过我们昊量光电的官方网站www.auniontech.com了解更多的产品信息,或直接来电咨询4006-888-532。
参考文献
1. Peterka, D. S., Takahashi, H. & Yuste, R. Imaging voltage in neurons. Neuron 69, 9–21 (2011).
2. Luo, L., Callaway, E. M. & Svoboda, K. Genetic dissection of neural circuits: a decade of progress. Neuron 98, 256–281 (2018).
3. Stroh, A. et al. Making waves: initiation and propagation of corticothalamic Ca2+ waves in vivo. Neuron 77, 1136–1150 (2013).
4. Schwalm, M. et al. Cortex-wide BOLD fMRI activity reflects locally-recorded slow oscillation-associated calcium waves. eLife 6, e27602 (2017).
5. Adelsberger, H., Grienberger, C., Stroh, A. & Konnerth, A. In vivo calcium recordings and channelrhodopsin-2 activation through an optical fiber. Cold Spring Harb. Protoc. 2014, pdb.prot084145 (2014).
6. Fuhrmann, F. et al. Locomotion, theta oscillations, and the speed-correlated firing of hippocampal neurons are controlled by a medial septal glutamatergic circuit. Neuron 86, 1253–1264 (2015).
7. Simone, K., Füzesi, T., Rosenegger, D., Bains, J. & murari, K. Open-source, cost-effective system for low-light in vivo fiber photometry. Neurophotonics 5, 025006 (2018).
8. Muir, J. et al. In vivo fiber photometry reveals signature of future stress susceptibility in nucleus accumbens. Neuropsychopharmacology 43, 255–263 (2018).
9. Adelsberger, H., Zainos, A., Alvarez, M., Romo, R. & Konnerth, A. Local domains of motor cortical activity revealed by fiber-optic calcium recordings in behaving nonhuman primates. Proc. Natl Acad. Sci. USA 111, 463–468 (2014).
10. Lu, L. et al. Wireless optoelectronic photometers for monitoring neuronal dynamics in the deep brain. Proc. Natl Acad. Sci. USA 115, E1374–E1383 (2018).
11. Meng, C. et al. Spectrally Resolved fiber photometry for multi-component analysis of brain circuits. Neuron 98, 707–717.e4 (2018).
12. Cui, G. et al. Concurrent activation of striatal direct and indirect pathways during action initiation. Nature 494, 238–242 (2013).
13. Markowitz, J. E. et al. The striatum organizes 3D behavior via moment- to-moment action selection. Cell 174, 44–58 (2018).
14. Kim, C. K. et al. Simultaneous fast measurement of circuit dynamics at multiple sites across the mammalian brain. Nat. Methods 13, 325–328 (2016).
15. Gunaydin, L. A. et al. Natural neural projection dynamics underlying social behavior. Cell 157, 1535–1551 (2014).
16. Schmid, F. et al. Assessing sensory versus optogenetic network activation by combining (o)fMRI with optical Ca2+ recordings. J. Cereb. Blood Flow. Metab. 36, 1885–1900 (2016).
17. Lütcke, H. et al. Optical recording of neuronal activity with a genetically-encoded calcium indicator in anesthetized and freely moving mice. Front. Neural Circuits 4, 9 (2010).
18. Guo, Q. et al. Multi-channel fiber photometry for population neuronal activity recording. Biomed. Opt. Express 6, 3919 (2015).
19. Cui, G. et al. Deep brain optical measurements of cell type–specific neural activity in behaving mice. Nat. Protoc. 9, 1213–1228 (2014).
20. Tai, D. C. S., Hooks, D. A., Harvey, J. D., Smaill, B. H. & Soeller, C. Illumination and fluorescence collection volumes for fiber optic probes in tissue. J. Biomed. Opt. 12, 034033 (2007).
21. Pisanello, M. et al. The three-dimensional signal collection field for fiber photometry in brain tissue. Front. Neurosci. 13, 82 (2019).
22. Pisanello, F. et al. Dynamic illumination of spatially restricted or large brain volumes via a single tapered optical fiber. Nat. Neurosci. 20, 1180–1188 (2017).
23. Park, S. et al. One-step optogenetics with multifunctional flexible polymer fibers. Nat. Neurosci. 20, 612–619 (2017).
24. Acker, L., Pino, E. N., Boyden, E. S. & Desimone, R. FEF inactivation with improved optogenetic methods. Proc. Natl Acad. Sci. USA 113, E7297 (2016).
25. Pisanello, F. et al. Multipoint-emitting optical fibers for spatially addressable in vivo optogenetics. Neuron 82, 1245–1254 (2014).
26. Pisano, F. et al. Focused ion beam nanomachining of tapered optical fibers for patterned light delivery.Microelectron. Eng. 195, 41–49 (2018).
27. Pisanello, M. et al. Tailoring light delivery for optogenetics by modal demultiplexing in tapered optical fibers. Sci. Rep. 8, 4467 (2018).
28. Pisanello, M. et al. Modal demultiplexing properties of tapered and nanostructured optical fibers for in vivo optogenetic control of neural activity. Biomed. Opt. Express 6, 4014 (2015).
29. Klaus, A. et al. The spatiotemporal organization of the striatum encodes action space. Neuron 95, 1171–1180 (2017).
30. Patriarchi, T. et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science 360, 1420 (2018).
31. Howe, M. W. & Dombeck, D. A. Rapid signalling in distinct dopaminergic axons during locomotion and reward. Nature 535, 505–510 (2016).
32. Coddington, L. T. & Dudman, J. T. Emergence of reward expectation signals in identified dopamine neurons. Nat. Neurosci. 21, 1563–1573 (2018).
33. da Silva, J. A., Tecuapetla, F., Paixão, V. & Costa, R. M. Dopamine neuron activity before action initiation gates and invigorates future movements. Nature 554, 244–248 (2018).
34. Rizzo, A. et al. laser micromachining of tapered optical fibers for spatially selective control of neural activity. Microelectron. Eng. 192, 88–95 (2018).
35. Tanese, D. et al. Imaging membrane potential changes from dendritic spines using computer-generated holography. Neurophotonics 4, 031211 (2017).
36. Wang, T. et al. Three-photon imaging of mouse brain structure and function through the intact skull. Nat. Methods 15, 789–792 (2018).